Le carbone
Elément chimique de numéro 6, le carbone est très commun sur Terre. On le retrouve sous deux formes principales dans la nature : le diamant et le graphite. Nous avons réalisé et photographié les deux modèles moléculaires de la structure de ces matériaux pour mieux les visualiser.
La formation du diamant nécessite de hautes températures et pressions : il faut 1100 à 1400 °C et entre 4,5 GPa et 6 GPa pour en obtenir. Ces conditions sont réunies dans une certaine zone de la planète, il s'agit du manteau supérieur et inférieur sous les continents. De manière générale, les diamants cristallisent de 150 à 200 km sous la croûte.
Ce matériau est souvent présent dans la kimberlite diamantifère, qui est une roche trouvable dans le craton, zone ancienne de la croûte continentale et de la lithosphère.
Le diamant est très solide, du fait de sa structure cristalline, qui est une structure dérivée du cubique faces centrées. En effet, chaque atome est associé de façon tétraédrique à ses voisins : cela complète la couche électronique extérieure et crée des liaisons covalentes très dures et très solides, difficiles à briser. Il a 8 atomes par maille : 4 dans la maille et 4 dans les sites tétraédriques. Le diamant est ainsi le plus dur des matériaux naturels (10 sur l'échelle de Mohs).
Le graphite, quant à lui, a une structure constituée de plusieurs plans parallèles d'atomes agencés en un pavage d'hexagones. Cela permet aux atomes d'avoir trois fortes liaisons covalentes et une autre liaison plus faible puisque plus longue, qui permet la mobilité d'électrons dans le graphite dans le plan des feuillets. C'est donc un matériau qui est conducteur électrique et thermique.
La plupart du temps, le carbone présent dans le manteau terrestre date de la formation de la Terre, mais il peut aussi venir d'algues en décomposition qui ont été enfouies profondément à cause de l'activité sismique de la Terre. Par exemple, certaines plaques subduites ont entraîné le carbone avec elles dans le manteau terrestre.
Sa 4ème liaison plus faible explique la faible dureté du matériau et son clivage puisqu'elle maintiendrait les plans ensemble par des interactions de Van der Waals (des faibles interactions). Les feuillets s'effritent facilement, c'est pour cela que certains crayons ont des mines en graphite. Voici la représentation de sa structure :

Un bout d'une maille de graphite. Comme le diamant, nous avons utilisé des modèles moléculaires. Pour la 4ème liaison maintenant les feuillets entre eux, nous avons dû nous aider de bouts de pailles.

La même, vue de dessus

La structure du diamant, réalisée avec des modèles moléculaires.
Ce matériau est également peu stable thermodynamiquement puisque ses conditions de formation sont extrêmes.
Ce matériau est généralement formé à partir de matière organique, piégée dans des roches, qui subit une pression et une température plus élevées que la normale au moment du métamorphisme. Ce graphite se forme aux alentours des 650-700°C.
Cette structure permet au diamant de former 4 sites tétraédriques dans une maille.
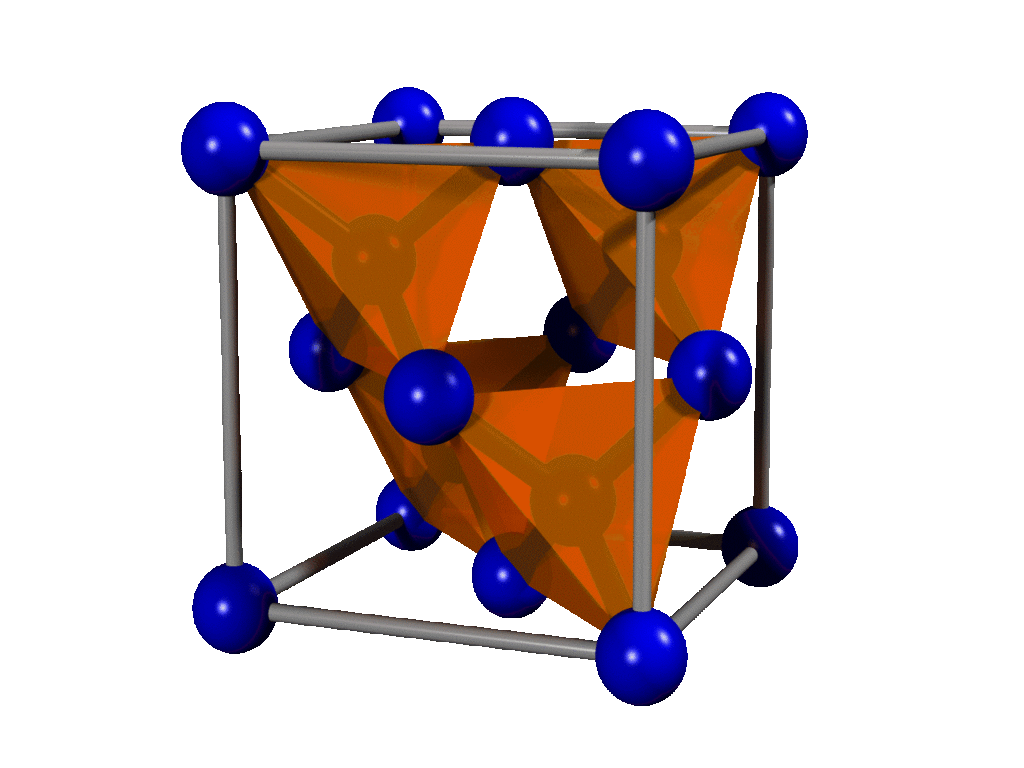
Structure de type diamant avec les 4 sites tétraédriques mis en évidence. Cette structure est typique au diamant, mais d'autres cristaux ont un arrangement semblable, notamment le silicium. (source : Pieter Kuiper - https://commons.wikimedia.org/w/index.php?curid=2198583)
Le diamant a permis une avancée considérable dans la recherche scientifique en physique de de la matière condensée, grâce à la mise point de la cellule à enclume de diamant. Ce dispositif permet de focaliser des rayons X (ou des laser) sur des matériaux de pouvoir étudier leur comportement dans des conditions de hautes pressions.
Le diamant est aussi utilisé dans la fabrication d'outils et d'équipements, comme par exemple les trépans, ou les meubles. Il est aussi exploité dans l'industrie automobile. Cependant il existe pleins de possibilités d'utiliser la diamant dans l'industrie de haute technologie : il entre dans la fabrication de fenêtres optiques de toutes nouvelles générations pour les laser de puissance, la transmission des rayonnements synchrotron, de détecteurs pour les rayonnements ionisants ou ultraviolet et de puits de chaleur permettant de refroidir les composants électroniques.
